Produire des plaquettes sanguines
Des chercheurs ont mis au point un dispositif microfluidique qui produit en quelques heures une grande quantité de plaquettes sanguines. Ces travaux, qui ouvrent la voie à la production in vitro de plaquettes est le fruit d’une collaboration entre physiciens et biologistes (laboratoire Gulliver/ESPCI Paris et Inserm) et la start-up PlatOD. L’étude est publiée dans la revue Nature Scientific Reports et fait l’objet d’un brevet conjoint entre l’ESPCI, le CNRS, l’INSERM et PlatOD. Anne Le Goff, aujourd’hui enseignant-chercheur au laboratoire BMBI, raconte les recherches auxquelles elle a participé.
Les plaquettes sanguines sont des cellules anucléées de quelques microns de diamètre indispensables à la coagulation du sang. Les demandes de transfusion de plaquettes sont en constante augmentation, notamment à cause de l’accroissement des chimiothérapies et des transplantations de moelle osseuse.
Physiologiquement, les plaquettes se forment dans notre organisme par fragmentation du cytoplasme de très grosses cellules, les mégacaryocytes, présentes dans notre moelle osseuse. Or, on sait depuis quelques années que l’écoulement sanguin dans les capillaires qui irriguent la moelle joue un rôle fondamental dans la formation des plaquettes. Cette découverte a motivé une activité croissante dans le domaine des circuits microfluidiques dédiés à la fragmentation des mégacaryocytes et à la production de plaquettes.
La plupart des systèmes qui ont vu le jour cherchent à mimer la traversée de la moelle osseuse par les mégacaryocytes. Bien que les premières observations aient réussi à montrer la fragmentation du cytoplasme en plaquettes, les quantités de plaquettes produites ont été jusqu’à présent bien trop faibles pour permettre une caractérisation biologique correcte.Les chercheurs ont choisi une approche différente qui ne se limite pas à reproduire exactement les mécanismes à l’œuvre dans la moelle osseuse.
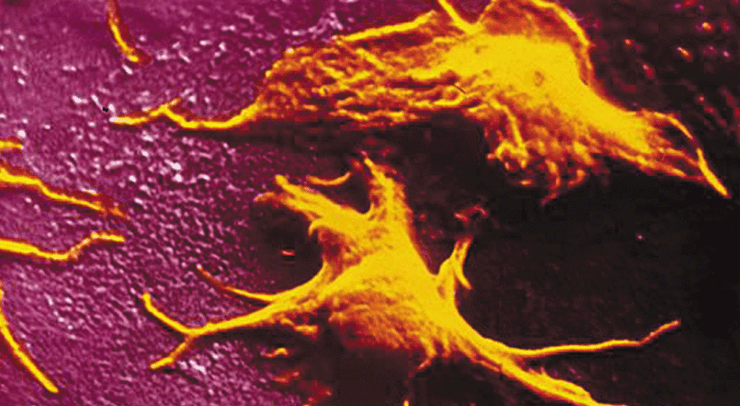
Dans leur système, la suspension de mégacaryocytes est directement mise en écoulement dans une chambre microfluidique garnie d’une multitude de piliers sur lesquels les cellules adhèrent en restant exposées aux forces hydrodynamiques qui favorisent l’élongation et la fragmentation des cellules. Les scientifiques ont pu observer la réorganisation du cytosquelette des mégacaryocytes qui prennent la forme de colliers de perles (cf. photo). Le cytoplasme se coupe alors sous l’action de l’écoulement en libérant régulièrement des plaquettes dans le flux de la perfusion.
« Grâce à ces centaines de milliers de micropiliers qui peuplent notre puce, nous pouvons en 2h de temps produire des plaquettes en quantité suffisante pour permettre leur caractérisation biologique. Nous avons montré que conformément à ce qu’on espèrerait, les plaquettes ne sont pas activées à la sortie du bioréacteur mais qu’elles sont sensibles à une activation chimique et semblent donc à même de remplir leur fonction de coagulation chez un receveur», confie Mathilde Reyssat, chercheuse au laboratoire Gulliver à l’ESPCI. Ces résultats originaux sont le fruit d’une riche collaboration entre des physiciens, des biologistes et des médecins. Ces chercheurs de laboratoires académiques ont travaillé main dans la main avec les ingénieurs de la start-up PlatOD, créée par Dominique Baruch, dont l’objectif est de pouvoir produire d’ici quelques années des plaquettes à la demande.
Ces travaux constituent une première étape vers la production de plaquettes sanguines in vitro à grande échelle et vers de nouvelles voies de transfusion. De nombreuses études restent cependant à mener comme des tests de coagulation in vivo chez l’animal, puis, à plus long terme, des essais cliniques qui devraient voir le jour d’ici quelques années.




